发布时间:2016-05-19

举办单位:

会议时间:2016年05月27日,共1天(09:00-17:00)
会议地点:苏州工业园区仁爱路199号苏大校园
参与人员:医疗器械企业法规专员、注册专员、品质经理、技术管理者代表等
参会费用:每家公司2人免费(因场地有限,医疗器械生产企业优先)
会议摘要:
生物相容性检测是医疗器械上市前必须通过的安全性检测,与每一个医疗器械生产于销售企业相关。ISO 10993 是医疗器械生物安全性评价的国际标准,在这个基础上美国FDA 与2013年04月发布了Use of International Standard ISO- 10993, "Biological Evaluation of Medical Devices Part 1: Evaluation and Testing",指导医疗器械制造商及检测单位如何使用ISO 10993-1,正确选择评价试验,并对常用试验提出了额外的检测要求。本课程将从试验选择、生物安全试验的常规考虑、具体试验注意事项、评价已知毒性或潜在毒性的化学个体等几个方面为大家解读该导则,从而帮助制造商从生产开始就注意到规避生物安全风险,使产品顺利通过生物安全检测。同时针对国内、欧盟、美国、巴西等多国生物相容性标准差异性进行分析。
ANVISA 是巴西国家卫生监督局National Health Surveillance Agency的简称,ANVISA是一个独立管理、财务自主的机构。在联邦公共行政部门的体制内,ANVISA与卫生部挂钩。ANVISA的目的是通过控制产品的生产和销售,来促进和保护居民的健康。
FDA医疗器械法规包括器械上市前和上市后两大部分,其中上市前部分的核心是“上市前批准(PMA)”和“上市前通告(PMN,也即510(k))”;上市后部门的核心为“医疗器械质量体系法规(QSR820)”和“医疗器械报告(MDR)”。
近年来,随着我们医疗器械行业的发展,出口美国巴西市场企业越来越多,医疗器械企业对FDA及巴西法规知识的渴求越来越强烈。INMETRO认证要如何准备?FDA相关的PMA、510(k)、DENOVO的基本要求与关注点在哪里?ANVISA与FDA又有什么不同?BGMP与QSR820又存在怎样的差异?在这里卓远天成咨询公司将携手苏州大学卫生与环境技术研究所、必维国际检验集团的医疗器械首席专家为大家答疑解惑。
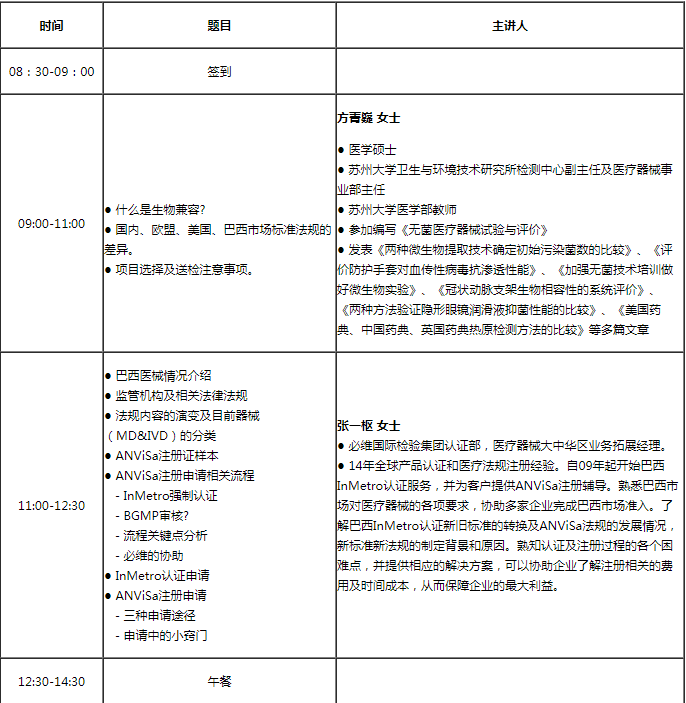
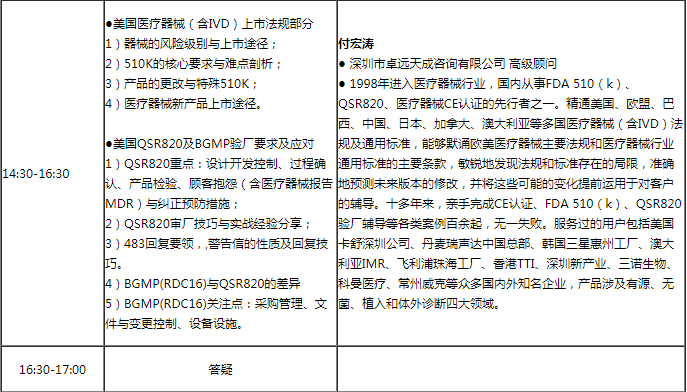
课程大纲